Kalor adalah salah satu bentuk energi yang berpindah dari benda yang bersuhu tinggi ke benda yang bersuhu lebih rendah.
Didefinisikan sebagai jumlah kalor yang ketika diberikan pada 1 gram air akan menaikkan suhu air tersebut 1 derajat celsius.
Satuan dalam SI adalah joule dimana :
1 cal= 4,2 joule
1 joule=0,24 cal
b.Sifat
1.Kalor dapat mengubah suhu suatu benda
Benjamin
Thompson yaitu ilmuwan asal Amerika tahun 1798 melakukan pengamatan
dari 2 suhu yang dicampur menjadi 1 dan diberikan kesimpulan bahwa:
jumlah kalor yang diperlukan untuk mengubah suhu suatu benda ditentukan
oleh massa suatu zat (m), perubahan suhunya (Δt), dan kalor jenis zat (c) benda yang dipanaskan
Sehingga dapat dirumuskan:
Q= m x c x Δt
Ket:
Q = Jumlah kalor yang diperlukan unutk mengubah suhu suatu benda (joule)
m = Massa benda (kg)
c = Kalor Jenis Zat (joule/kg °C)
Δt = perubahan suhu (°C)/ selisih suhu yaitu t₂ - t₁
Kalor jenis suatu zat adalah banyaknya kalor yang diperlukan untuk menaikkan suhu 1kg zat sebesar 1°C atau 1K
Kalor Jenis berbagai Zat
Zat
|
Kalor Jenis (J/Kg°C)
|
Udara
|
1000
|
Air
|
4200
|
Alkohol
|
2400
|
Raksa
|
140
|
Parafin
|
2200
|
Es
|
2100
|
Aluminium
|
900
|
Tembaga
|
390
|
Kaca
|
670
|
Besi
|
450
|
Emas
|
130
|
Perak
|
234
|
Ket: Semakin rendah kalor jenis suatu benda maka akan lebih cepat panas
Kalorimeter adalah alat untuk mengukur kalor.
Salah satu bentuknya adalah kalorimeter campuran
Pengaruh Kalor dalam kehidupan sehari - hari: pada daerah pantai
Kapasitas kalor: Jumlah kalor yang diperlukan untuk menaikkan suhu 1°C atau 1K
Dirumuskan:
Q = C x Δt
C = m x c
Ket:
Q = jumlah kalor (joule)
C = Kapasitas kalor (J/°C atau J/K)
m = Massa benda (kg)
c = Kalor jenis zat (joule/kg °C)
Δt = Perubahan suhu (°C)
2. Kalor dapat mengubah wujud suatu benda
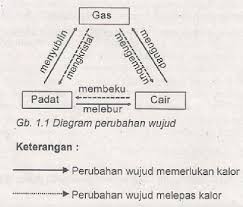
Perbedaan mendidih dan menguap:
Mendidih : 100°C, seluruh permukaan, terdapat gelembung udara
Menguap : dibawah 100°C, permukaan tidak ada gelembung udara
Menyerap kalor : endoterm
Melepas kalor : eksoterm
Deposisi : perubahan wujud benda dari gas ke padat tanpa ada fase cair

Kalor uap = kalor embun
Kalor didih = titik embun
2. Kalor dapat mengubah wujud suatu benda
Perbedaan mendidih dan menguap:
Mendidih : 100°C, seluruh permukaan, terdapat gelembung udara
Menguap : dibawah 100°C, permukaan tidak ada gelembung udara
Menyerap kalor : endoterm
Melepas kalor : eksoterm
Deposisi : perubahan wujud benda dari gas ke padat tanpa ada fase cair
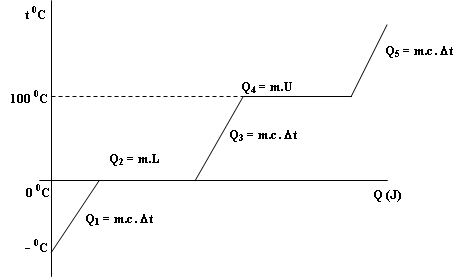
Banyaknya kalor yang diserap atau yang dilepaskan (Q) dalam proses perubahan wujud benda dapat dinyatakan dengan rumus:
Q = m x L
Ket:
Q = Jumlah kalor (joule)
m = Massa benda (kg)
L = Kalor laten (Kalor lebur, kalor beku, kalor uap, kalor embun, kalor sublim, kalor kristal)(J/kg)
Kalor
laten adalah kalor yang diserap atau yang dilepas pada saat terjadi
perubahan wujud benda tidak menyebabkan perubahan suhu benda (suhu benda
konstan)
Kalor laten beberapa zat
Kalor laten beberapa zat
Kalor uap = kalor embun
Kalor didih = titik embun
c. Asas Black
Tahun
1799, Joseph Black, seorang ahli kimia berkebangsaan Inggris melakukan
penyelidikan tentang pelepasan dan penerimaan kalor. Hasilnya adalah
teori yang disebut Asas Black yang berbunyi: "besarnya kalor yang
dilepaskan oleh suatu benda sama dengan besarnya kalor yang diterima
oleh benda lain."
Dirumuskan:
Dirumuskan:
Qlepas = Qterima
m x c x Δt = m x c x Δt
m x c x Δt = m x c x Δt

Catatan:
Kalor jenis suatu benda tidak tergantung dari massa benda tetapi tergantung pada sifat dan jenis benda tersebut.
Pada setiap penyelesaian soal Asas Black, lebih mudah jika dibuat diagram alirnya
Kalor dapat dibagi menjadi 2 jenis
Konverensi Energi Listrik menjadi Energi Kalor
Kalor jenis suatu benda tidak tergantung dari massa benda tetapi tergantung pada sifat dan jenis benda tersebut.
Pada setiap penyelesaian soal Asas Black, lebih mudah jika dibuat diagram alirnya
Kalor dapat dibagi menjadi 2 jenis
- Kalor yang digunakan untuk menaikkan suhu
- Kalor yang digunakan untuk mengubah wujud (kalor laten), persamaan yang digunakan dalam kalor laten ada dua macam Q = m.U dan Q = m.L. Dengan U adalah kalor uap (J/kg) dan L adalah kalor lebur (J/kg)
Konverensi Energi Listrik menjadi Energi Kalor
Asas
Black merupakan penerapan dari hukun Kekekalan Energi, yaitu jumlah
seluruh energi tidak dapat diciptakan atau dimusnahkan, tetapi bida
diubah atau dikonversi menjadi bentuk energi yang lain.
Contoh: Dispenser dan Water Hitter
Hubungan konversi energi listrik menjadi energi kalor dirumuskan:
W = Q
P x t = m x c x Δt
Keterangan:
W = energi listrik (joule)
Q = jumlah kalor yang diserap atau dilepaskan (joule)
P = daya listrik (watt)
t = selang waktu pemakaian listrik (sekon)
m = massa benda (kg)
c = kalor jenis zat (joule/kg°C)
Contoh: Dispenser dan Water Hitter
Hubungan konversi energi listrik menjadi energi kalor dirumuskan:
W = Q
P x t = m x c x Δt
Keterangan:
W = energi listrik (joule)
Q = jumlah kalor yang diserap atau dilepaskan (joule)
P = daya listrik (watt)
t = selang waktu pemakaian listrik (sekon)
m = massa benda (kg)
c = kalor jenis zat (joule/kg°C)










